
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Типы химических реакций
|
|
1. Отметьте схемы гомогенных реакций: а) 4Р +5О2→; б) 2Н2 + +О2→; в) 2Н2S(г.) + SО2→; г) 2NН3(г.) + Н2SO4→.
2. Отметьте схемы гетерогенных реакций: а) Сu + Вr2→; б) С + +H2O→; в) 3Н2 + СО→; г) СН3ОН + Н2SO4→.
3. Отметьте схемы реакций замещения: а) Сu + 2АgF→; б) Р2О5 + +2 НNO3→; в) 2Аl + Fe2О3→; г) С2Н4 + Вr2→.
4. Отметьте схемы реакций обмена: а) H2O + Ba→; б) НСl + +NH3→; в) С2Н2 + НВr→; г) СuО + Н2SO4→.
5. Отметьте схемы реакций присоединения: а) Zn(ОН)2 + +2NаОН(р-р)→; б) 2 FeСl2 + Сl2→; в) Сu(ОН)2 + 2 НСl; г) Fe + +2АgNO3→.
6. Укажите каталитические реакции: а) 4NН3 + 5О2= 4NO + 6Н2О; б) 2СО + О2 = 2СО2; в) 2SО2 + О2 = 2SО3; г) С6Н6 + Вr2 = НВr+ +С6Н5Вr.
7. Какие реакции являются экзотермическими: а) СН4 + 2О2 = =СО2 + 2Н2О; б) S + О2 = SО2; в) N2 + О2 = 2NО; г) 4Р +5О2 = =2Р2О5.
8. Какие реакции являются эндотермическими: а)2КСlО3=
=2КСl +3О2; б) 4NН3 + 5О2= 4NO + 6Н2О; в) 2NаОН + Н2SO4 = =Nа2SO4 + 2Н2О; г) SО3 + Н2О = Н2SO4.
9. Отметьте схемы экзотермических реакций: а) 2Nа + 2Н2О®;
б) К2О + Н2О®; в) СаСО3  ; г) 2Н2 + О2®.
; г) 2Н2 + О2®.
10. Отметьте схемы обратимых реакций: а) СО2 + Н2О®;
б) SО3 + Н2О→; в) SО2 + О2®; г) СН3ОН + СН3СООН 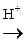 .
.
11.Отметьте схемы необратимых реакций: а) СuО + Н2SO4®; б) КСlр-р + НВrр-р®; в) СН4 + 2О2®; г) 4Р + 3О2®.
12. При сгорании 1 моль графита в избытке кислорода выделяется 393, 5 кДж теплоты. Какую массу графита нужно сжечь, чтобы выделилось 7870 кДж теплоты: а) 110 г; б) 120 г;
в) 240 г; г) 393, 5 г.
13.На протекание реакции 2 KNO3 ® 2KNO2 + O2 Q = –254, 8 кДж затратили 127, 4 кДж теплоты. Какой объем кислорода (н.у.) выделился при этом? а) 5, 6 дм3; б) 11, 2 дм3; в) 22, 4 дм3;
г) 28, 6 дм3.
14.Какое количество теплоты выделится при сгорании серы массой 8 г, если реакция идет по уравнению S(т) + О2 (г) = SO2 (г),
Q = 296, 9 кДж/моль? а) 29, 69 кДж; б) 74, 23 кДж; в) 148, 45 кДж; г) 296, 9 кДж.
15.При сгорании 1 г водорода выделяется 143 кДж энергии. Тепловой эффект данной химической реакции равен: а) 286 кДж; б) 362 кДж; в) 572 кДж; г) 623 кДж.
16.На сгорание 7 г азота затрачивается 45, 2 кДж энергии. В каком случае правильно составлено термохимическое уравнение данной реакции? а) N2 + О2 = 2NO + 90, 4 кДж; б) N2 + О2 = =2NO + 180, 8 кДж; в) N2 + О2 = 2NO – 90, 4 кДж; г) N2 + О2 = =2NO – 180, 8 кДж.
17.Какие из указанных уравнений реакций являются термохимическими? а) 2СО + О2  2СО2; б) С(тв.)+ О2(газ)
2СО2; б) С(тв.)+ О2(газ)  СО2(газ);
СО2(газ);
в) Н2(газ) + Сl2(газ)= 2НСl(газ) + 184, 6 кДж; г) 2Н2 + О2 = 2Н2О + 572 кДж.
18.Тепловой эффект реакции 2Н2 + О2 → 2H2O равен 572 кДж. Какое количество теплоты выделится при сгорании 5, 6 л Н2 (н.у.)? а) 36 кДж; б) 71, 5 кДж; в) 86 кДж; г) 92, 4 кДж.
19.Осуществляется процесс восстановления в ходе:
а) превращения нейтрального атома в катион;
б) превращения простого аниона в нейтральный атом;
в) уменьшения заряда простого катиона;
г) превращения нейтрального атома в простой анион.
20.Отметьте схемы окислительно-восстановительных реакций:
а) РН3 + О2→ Р2О5 + Н2О; б) Са(ОН)2 + СО2→ Са(НСО3)2;
в) FeCl2 + Cl2→ FeCl3; г) (NН4)2СО3→ NН3 + Н2О + СО2.
21.Какие реакции не являются окислительно-восстановитель-ными? а) 2Nа + 2Н2О = 2NаОН + Н2; б) Nа2О + Н2О = 2NаОН; в) Р2О3 + О2→ Р2О5; г) Fe + CuSO4= FeSO4+Cu.
22.Укажите схемы процессов окисления: а) SО32- → SО42-;
б) Cl-→ ClO4-; в) РО43- + 2Н+→ Н2РО4-; г) СаОН+→ Са2+.
23.Укажите схемы процессов восстановления: а) NO3-→ NO2-;
б) РО43-→ Р2О74-; в) I2→ 2I-; г) Мn2+→ MnO4-.
24.В каких соединениях фосфор может проявлять окислительные свойства? а) Р2О5; б) Р2О3; в) РН3; г) К2НРО3.
25.В каких соединениях хлор может проявлять только окислительные свойства? а) NaClO4; б) КClO3; в) Cl2O; г) НCl.
26.В каких соединениях сера может проявлять окислительно – восстановительную двойственность? а) Nа2S2О3; б) SF6;
в) SCl4; г) СS2.
27.В каких соединениях азот может проявлять только восстановительные свойства? а) аммиак; б) карбонат аммония; в) гидроксиламин; г) азотистая кислота.
28.В каких соединениях хлор может выступать в роли восстановителя? а) РСl3; б) НClO; в) Cl2O7; г) НClO3.
29.Как изменяется степень окисления элемента при окислении? а) не изменяется; б) всегда уменьшается; в) всегда увеличивается; г) может как уменьшаться, так и увеличиваться.
30.Какие частицы в ОВР могут выступать только в роли восстановителя? а) S2-; б) Cs0; в) Са2+; г) С.
31.Какие частицы в ОВР могут проявлять окислительно-восстановительную двойственность? а) Fе2+; б) К+; в) F2; г) N2.
32.Укажите схемы межмолекулярных ОВР: а) N2Н4 + О2→ NO + +H2O; б) С2Н2→ С6Н6; в) Р + О2→ Р2О5; г) НNO3 + Zn = NO2 + +Zn(NO3)2 + Н2О.
33.Укажите схемы внутримолекулярных ОВР: а) КClO3→ КCl+ +О2; б) NН4НСО3→ NН3 + СО2 + Н2О; в) Cl2 + Н2О→ НCl+ +НClO; г) СаСО3→ СаО + СО2.
34.Укажите схемы реакций диспропорционирования: а) К2SO3→ → К2SO4 + К2S; б) Са(NO3)2→ Са(NO2)2 + О2; в) S + NaOH ® → Na2SO3 + Na2S + H2O; г) Cu(NO3)2→ CuО + NO2 + О2.
35.Сколько моль НNO3 затрачивается на солеобразование при окислении 4 моль Fe в реакции, протекающей по схеме Fe + +HNO3 ® Fe(NO3)3 + NН4NO3 + Н2О? а) 12; б) 13, 5; в) 27;
г) 30.
36.Сколько моль НNO3 затрачивается в процессе окисления 8 моль Mg в реакции, протекающей по схеме Mg + HNO3 ® Mg(NO3)2 + +Н2О + NH4NO3? а) 2; б) 4; в) 10; г) 12.
37.Какой оксид азота выделился в результате взаимодействия НNO3 с металлом, если известно, что в процессе восстановления четыре моль атомов азота присоединили к себе шестнадцать моль электронов? а) N2O; б) NO; в) N2O3; г) NO2.
38.Какое суммарное количество НNO3 расходовалось при окислении 9 моль Cu в реакции, протекающей по схеме Cu + +HNO3→ Cu(NO3)2 + NO + H2O? а) 8 моль; б) 16 моль; в) 22 моль; г) 24 моль.
39.В качестве окислителя ионы Н+ могут выступать по отношению к металлам: а) Fe; б) Cu; в) Pb; г) Hg.
40.Укажите сумму коэффициентов перед формулами веществ в ОВР, протекающей по схеме НNO3 + Zn = NH4NO3 + Zn(NO3)2 + H2O: а) 21; б) 22; в) 30; г) 28.
41.Укажите сумму коэффициентов для ОВР, протекающей по схеме H2S + HNO3 ® S + NO + H2O: а) 12; б) 14; в)10; г) 16.
42.Укажите сумму коэффициентов перед формулами веществ в ОВР, протекающей по схеме NO2 + O2 + NaOH ® NaNO3 + H2O: а) 14; б) 15; в) 12; г) 16.
43.Укажите сумму коэффициентов перед формулами веществ в ОВР, протекающей по схеме Na2SO3 + KMnO4 + H2O ® Na2SO4 + MnO2 + KOH: а) 12; б)13; в) 15; г) 16.
44.Укажите сумму коэффициентов перед формулами веществ для ОВР, протекающей по схеме Zn + HNO3 ® Zn(NO3)2 + NH3 + H2O: а) 19; б) 20; в) 21; г) 24.
45.Укажите сумму коэффициентов перед формулами веществ в ОВР, протекающей по схеме S + KOH ® K2SO3 + K2S + H2O: а) 13; б) 14; в) 15; г) 17.
46.Укажите сумму коэффициентов перед формулами веществ в ОВР, протекающей по схеме Fe + HNO3 ® Fe(NO3)3 + NO + H2O: а) 11; б) 9; в) 6; г) 10.
47.Укажите сумму коэффициентов перед формулами веществ в ОВР, протекающей по схеме Fe + HNO3 ® Fe(NO3)3 + NO2 + H2O: а) 7; б) 14; в) 21; г) 15.
48.Укажите сумму коэффициентов перед формулами веществ в ОВР, протекающей по схеме NaI + NaBrO3 + HCl ® I2 + NaBr + NaCl + H2O: а) 28; б) 30; в) 26; г) 24.
49.Укажите сумму коэффициентов для ОВР, протекающей по схеме Cu + HNO3 ® Cu(NO3)2 + NO + H2O: а) 18; б) 20; в) 23; г) 19.
50.Укажите сумму коэффициентов перед формулами веществ в ОВР, протекающей по схеме Al + HNO3 ® Al(NO3)3 + NO + H2O: а) 8; б) 9; в)11; г) 12.
51.Укажите сумму коэффициентов для ОВР, протекающей по схеме NaBr + KMnO4 +H2O = Br2 + MnO2 + NaOH + KOH: а) 28; б) 25; в) 32; г) 26.
52.Укажите сумму коэффициентов перед формулами веществ в ОВР, протекающей по схеме P + HNO3 + H2O ® H3PO4 + NO: а) 16; б) 17; в) 18; г) 20.
53.Укажите сумму коэффициентов для ОВР, протекающей по схеме KI + KMnO4 + H2SO4 ® MnSO4 + I2 + K2SO4 + H2O:
а) 39; б) 41; в) 44; г) 47.
54.Укажите сумму коэффициентов перед формулами веществ в ОВР, протекающей по схеме KClO3 + HCl ® Cl2 + KCl + H2O: а) 12; б) 13; в) 14; г) 15.
55.Укажите сумму коэффициентов перед формулами веществ в ОВР, протекающей по схеме H2S + HNO3 ® H2SO4 + NО2 + H2O: а) 20; б) 21; в) 22; г) 23.
56.Укажите сумму коэффициентов перед формулами веществ в ОВР, протекающей по схеме P + KClO3 ® KCl + P2O5: а) 18;
б) 19; в) 21; г) 22.
57.Укажите сумму коэффициентов перед формулами веществ в ОВР, протекающей по схеме Ag + HNO3®AgNO3 + NO + H2O: а) 12; б) 13; в) 14; г) 15.
58.Укажите сумму коэффициентов перед формулами веществ для ОВР, протекающей по схеме HI + H2SO4 ® I2 + H2S + H2O:
а) 16; б) 18; в) 19; г) 20.
59.Укажите сумму коэффициентов для ОВР, протекающей по схеме Аl + HNO3 р. ® Аl(NO3)3 + NH4NO3 + H2O: а) 48; б) 52; в) 46; г) 58.
60.Укажите сумму коэффициентов перед формулами веществ в ОВР, протекающей по схеме K + HNO3 ® KNO3 + N2O + H2O: а) 31; б) 32; в) 29; г) 33.
61.Укажите сумму коэффициентов перед формулами веществ в ОВР, протекающей по схеме H2S + Br2 + H2O ® H2SO4 + HBr: а) 18; б) 16; в) 19; г) 14.
62.Укажите сумму коэффициентов перед формулами веществ в ОВР, протекающей по схеме KСlO3 + H3PO3 ® KCl + H3PO4: а) 6; б) 8; в) 9; г) 7.
63.Укажите сумму коэффициентов перед формулами веществ в ОВР, протекающей по схеме KNO2 + KMnO4 + H2O ® KNO3 + MnO2 + KOH: а) 12; б) 13; в) 15; г) 16.
64.Укажите сумму коэффициентов перед формулами веществ в ОВР, протекающей по схеме Fe+H2SO4®Fe2(SO4)3+SO2+H2O: а) 17; б) 18; в) 19; г) 21.
65.Укажите сумму коэффициентов перед формулами веществ в ОВР, протекающей по схеме C + HNO3 ® CO2 + NO + H2O:
а) 15; б) 16; в) 17; г) 20.
66.Укажите сумму коэффициентов перед формулами веществ в ОВР, протекающей по схеме MnO2 +KBr + H2SO4 ® MnSO4 + Br2 + K2SO4 + H2O: а) 6; б) 8; в) 10; г) 12.
67.Укажите сумму коэффициентов перед формулами веществ в ОВР, протекающей по схеме Mg+HNO3®Mg(NO3)2+N2+H2O: а) 28; б) 29; в) 30; г) 31.
68.Укажите сумму коэффициентов перед формулами веществ для ОВР, протекающей по схеме Са+Н2SO4®CaSO4+H2S+H2O:
а) 14; б) 17; в) 18; г) 19.
69.Укажите сумму коэффициентов перед формулами веществ для ОВР, протекающей по схеме KMnO4 ® K2MnO4 + MnO2 + O2: а) 8; б) 9; в) 5; г) 7.
70.Укажите сумму коэффициентов перед формулами веществ в ОВР, протекающей по схеме AgNO3 + PH3 + H2O®Ag + H3PO4 + HNO3: а) 28; б) 30; в) 31; г) 32.
71.Укажите сумму коэффициентов перед формулами веществ в ОВР, протекающей по схеме Na2S + Cl2 + H2O ® Na2SO3 + HCl: а) 14; б) 15; в) 18; г) 20.
72.Укажите сумму коэффициентов перед формулами веществ в ОВР, протекающей по схеме Br2 + Ca3P2 + H2O ® HBr + Ca3(PO4)2: а) 34; б) 32; в) 30; г) 29.
73.Укажите сумму коэффициентов перед формулами веществ в ОВР, протекающей по схеме С6Н12О6 + КMnО4 + Н2SО4→ СО2+MnSО4+К2SО4+Н2О: а) 132; б) 168; в) 197; г) 205.
74.Укажите сумму коэффициентов перед формулами веществ в ОВР, протекающей по схеме СН3ОН + К2Сr2О7 + Н2SО4→ НСООН + Сr2(SО4)3 + К2SО4+Н2О: а) 26; б) 31; в) 38; г) 42.
75. Укажите сумму коэффициентов перед формулами веществ в ОВР, протекающей по схеме СН3NН2 + КMnО4 + Н2SО4 → MnSО4+К2SО4+ СО2+N2+ Н2О: а) 92; б) 102; в) 115; г) 149.
76.Укажите сумму коэффициентов перед формулами веществ в ОВР, протекающей по схеме Сu2S + HNO3 → Cu(NO3)2 + SО2 + NO + Н2О: а) 36; б) 48; в) 50; г) 62.
77.Укажите сумму коэффициентов перед формулами веществ в ОВР, протекающей по схеме СН2О + КMnО4 + Н2SО4 → НСООН + MnSО4 + К2SО4 + Н2О: а) 21; б) 35; в) 43; г) 49.
78.Укажите сумму коэффициентов перед формулами веществ в ОВР, протекающей по схеме As2S3 + HNO3 → H3AsO4 + SО2 + NO2 + Н2О: а) 36; б) 42; в) 51; г) 58.
79.Укажите сумму коэффициентов перед формулами веществ в ОВР, протекающей по схеме Ti2(SO4)3 + KClO3 + H2O → TiOSO4 + KCl + H2SO4: а) 17; б) 26; в) 31; г) 42.
80.Укажите сумму коэффициентов перед формулами веществ в ОВР, протекающей по схеме Cr(NO3)3 + NaBiO3 + HNO3 → H2Cr2O7 + Bi(NO3)3 + NaNO3 + H2O: а) 20; б) 28; в) 31; г) 39.
81.Укажите сумму коэффициентов перед формулами веществ в ОВР, протекающей по схеме Ca(ClO)2 + Na2S + H2O → CaCl2 + S + NaOH: а) 10; б) 12; в) 26; г) 33.
82.
|
83.Укажите сумму коэффициентов перед формулами веществ в ОВР, протекающей по схеме Fe3O4 + Al → Fe + Al2O3: а) 8;
б) 12; в) 24; г) 26.
84.Укажите сумму коэффициентов перед формулами веществ в ОВР, протекающей по схеме

| + KMnO4 → | 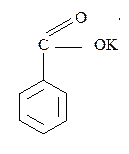
| + K2CO3 + MnO2 + H2O + KOH |
а) 19; б) 20; в) 25; г) 31.
85.Укажите сумму коэффициентов перед формулами веществ в ОВР, протекающей по схеме H2O2 + Na3[Cr(OH)6] → Na2CrO4 + H2O + NaOH: а) 14; б) 17; в) 18; г) 19.
86.Наиболее выражены окислительные свойства у: а) Cr; б) CrO; в) Cr2O3; г) CrO3.
87.Простое вещество может быть получено в реакциях:
а) обмена и замещения;
б) замещения и разложения;
в) разложения и обмена;
г) обмена и соединения.
88. Не относится к ОВР реакция:
а) взаимодействия хлороводорода с этанолом;
б) «серебряного зеркала»;
в) гидрирования этилена;
г) хлорирования бензола.
89. Относится к ОВР реакция:
а) гидролиза целлюлозы;
б) полимеризации этилена;
в) гидратации ацетилена;
г) нейтрализации уксусной кислоты гидроксидом кальция.
90. Катионы ртути Hg2+ являются окислителями в реакции:
а) ртуть (II) – оксида с азотной кислотой;
б) ртуть (II) – сульфата с сероводородом;
в) ртуть (II) – сульфата с медью;
г) ртуть (II) – оксида с магнием.
91. Укажите сумму коэффициентов перед формулами окислителя и воды в ОВР, протекающей по схеме:
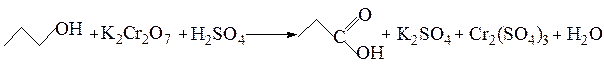
а) 13; б) 14; в) 15; г) 16.
92. Укажите сумму коэффициентов перед формулами восстановителя и КОН для реакции, протекающей по схеме:

а) 4; б) 5; в) 10; г) 14.
93. Какая масса (в кг) меди выделилась в ходе химической реакции, если на восстановление ионов Cu2+ затратили 15, 05∙ 1024 электронов? а) 0, 5; б) 0, 8; в) 1, 6; г) 1, 7.
94. Какое химическое количество (моль) электронов нужно затратить на восстановление алюминия из его оксида массой 255 г? а) 2, 5; б) 5; в) 10; г) 15.
95. Только за счет водорода проявляет окислительные свойства соединение, формула которого: а) NаН; б) NН2ОН; в) НСl;
г) НСlО4.
96. Только за счет водорода проявляет восстановительные свойства соединение, формула которого: а) NН4Сl; б) СаН2;
в) С6Н6; г) NаНSО4.
97. В каком ряду ионов степень окисления элемента фосфора возрастает слева направо?
а) НРО32-, НРО42-, Н2Р2О72-;
б) Н2РО2-, Н2РО3-, Р2О74-;
в) Н2РО4-, НРО42-, РО43-;
г) Н3Р2О7-, РО43-, Р2О74-.
98. В каком ряду соединений восстановительные свойства фосфора возрастают слева направо?
а) Н3РО4, Н3РО3, Н3РО2;
б) НРО3, Н4Р2О7, Na2НРО3;
в) КН2РО2, (NН4)2НРО4, СаНРО4;
г) К2НРО3, Н3РО2, Na2Н2Р2О7.
99. При взаимодействии металла с концентрированной H2SO4 образовалось 56 дм3 Н2S (н.у.). Сколько электронов в ходе окислительно-восстановительной реакции было отдано атомами этого металла? а) 15, 05 ∙ 1023; б) 30, 1 ∙ 1023;
в) 48, 16 ∙ 1023; г) 12, 04 ∙ 1024.
100. При взаимодействии металла с серной кислотой химическим количеством 0, 5 моль образовался металл (II) сульфат химическим количеством 0, 4 моль. Укажите формулу продукта восстановления серной кислоты: а) S; б) SO2; в) SO3; г) H2S.
101. Из перечисленных соединений как окислительные свойства, так и восстановительные свойства за счет атомов хлора способны проявлять: а) NaClO4; б) КClО3; в) Cl2; г) AlCl3.
102. В каких соединениях водород не может выступать в роли восстановителя? а) Н2О; б) СаН2; в) NН3; г) Н2.
103. При взаимодействии 0, 5 моль двухвалентного металла с НNО3 затратили 2 моль кислоты. Какой продукт восстановления молекул кислоты выделился при этом?
а) N2О; б) N2; в) NО; г) NО2.
104. На растворение 2 молей двухвалентного металла затратили 4, 8 моль азотной кислоты. Какой продукт восстановления молекул кислоты выделился при этом? а) N2О; б) N2; в) NО; г) NН4NО3.
105. Осуществляется процесс окисления в ходе:
а) увеличения заряда простого катиона;
б) получения молекул простого вещества из соответствующих простых анионов;
в) превращения простого катиона в соответствующий ему анион;
г) увеличения заряда простого аниона.
106. Химическая реакция какого типа, протекающая в водном растворе, не может быть окислительно–восстановительной?
а) реакция соединения;
б) реакция разложения;
в) реакция замещения;
г) реакция ионного обмена.
107. Экзотермическая реакция не может:
а) быть окислительно–восстановительной;
б) быть реакцией разложения;
в) протекать с поглощением теплоты;
г) быть реакцией нейтрализации.
108. Отметьте правильные утверждения: реакция горения:
а) не может быть окислительно–восстановительной;
б) не может быть реакцией соединения;
в) не может быть реакцией ионного обмена;
г) не может быть реакцией разложения.
109. Реакция между двумя простыми веществами не может быть:
а) окислительно–восстановительной;
б) реакцией соединения;
в) реакцией замещения;
г) эндотермической реакцией.
110. Реакция между двумя сложными веществами, протекающая в водном растворе, не может быть:
а) реакцией соединения;
б) окислительно–восстановительной;
в) реакцией разложения;
г) экзотермической.
111. Отметьте схемы процессов окисления:
а) Н2С2О4 → 2СО2+ 2Н+;
б) Мn2+ + 4Н2О → МnО4− + 8Н+;
в) 2СrО42− + 2Н+ → Сr2О72− + Н2О;
г) 2Сr3+ + 7Н2О → Сr2О72− + 14Н+.
112. Отметьте схемы процессов восстановления:
а) SO42− → S2О72− ;
б) 2Н2РО4− → Р2О74− ;
в) РО43− → НРО32− ;
г) [Al(OH)4]– → AlO2– + 2Н2О.
113. Какое число электронов отдается в процессе окисления при взаимодействии 5, 6 г Fe с 100 г 20%-го раствора Н2SО4?
а) 1, 204∙ 1023; б) 12, 04∙ 1023; в) 1, 806∙ 1023; г) 2, 408∙ 1023.
114. Какое число электронов присоединяется окислителем при взаимодействии 12, 8 г металлической меди с избытком азотной кислоты? а) 1, 204∙ 1023; б) 2, 408∙ 1023; в) 5, 606∙ 1023;
г) 4, 816∙ 1023.
115. В каких соединениях кислород может выступать только в роли окислителя? а) F2О; б) КО2; в) Н2О2; г) КNО3.
116. Эндотермическая реакция не может:
а) быть реакцией соединения;
б) протекать с выделением теплоты;
в) быть окислительно− восстановительной;
г) быть каталитической.
117. При взаимодействии алюминия с избытком соляной кислоты окислитель присоеденил к себе 3, 612∙ 1023 электронов. Какая масса алюминия вступила в реакцию? а) 5, 4 г; б) 8, 1 г;
в) 10, 6 г; г) 16, 2 г.
118. При взаимодействии магния с избытком разбавленного раствора Н2SО4 восстановитель отдал 9, 632∙ 1023 электронов. Какая масса кислоты вступила в реакцию? а) 49 г; б) 39, 2 г;
в) 156, 8 г; г) 78, 4 г.
119. Реакция всегда будет окислительно− восстановительной при взаимодействии между собой:
а) двух простых веществ;
б) двух сложных веществ;
в) металла и неметалла;
г) простого и сложного веществ.
120. При растворении железа в соляной кислоте выделилось 112 дм3 газа. Какое число электронов присоединил к себе окислитель в ходе процесса восстановления? а) 3, 01∙ 1024;
б) 6, 02∙ 1024; в) 9, 03∙ 1024; г) 12, 04∙ 1024.