
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Оксиды, основания, кислоты, соли
|
|
1. Сера(IV)-оксид выступает как кислотный оксид в реакции с:
а) сероводородом; б) калий-гидроксидом; в) кислородом; г) оксидом натрия.
2. Какие оксиды являются кислотными: а) марганец(VII)-оксид; б) алюминий-оксид; в) азот(V)-оксид; г) марганец(II)-оксид.
3. Какие оксиды являются основными? а) бериллий-оксид;
б) магний-оксид; в) медь(II)-оксид; г) хром(VI)-оксид.
4. В каких реакциях медь(II)-оксид проявляет свойства основного оксида? а) CuO + H2®; б) CuO + HCl®; в) CuO + CO®;
г) CuO + H2SO4®.
5. Какие оксиды являются основными? а) цинк-оксид;
б) хром(III)-оксид; в) калий-оксид; г) железо(II)-оксид.
6. Медь(II)-оксид может реагировать с: а) водородом;
б) углерод(II)-оксидом; в) натрий-оксидом; г) водой.
7. Кремний(IV)-оксид реагирует с: а) Н2О; б) Н2SO4; в) HF;
г) NaOH.
8. Какие оксиды являются кислотными оксидами? а) CrO;
б) Cr2O3; в) CrO3; г) SO3.
9. С какими веществами углерод(II)-оксид реагирует как восстановитель? а) кислородом; б) водородом; в) железо(II)-оксидом; г) натрий-гидроксидом.
10. В реакциях с какими веществами фосфор(V)-оксид выступает в роли кислотного оксида? а) О2; б) MgO; в) Ва (ОН)2; г) Н2О.
11. Укажите схемы реакций, которые не являются окислительно-восстановительными: а) SO2 + Na2O ®; б) Р2O3 + H2O ®;
в) SO2 + O2 ®; г) O2 + H2S ®.
12. Какие оксиды при н.у. находятся в твердом агрегатном состоянии? а) СO2; б) SiO2; в) Na2O; г) Р2О5.
13. В каких реакциях углерод(II)-оксид проявляет восстановительные свойства? а) СО + 2Н2 = СН3ОН; б) СО + 3 Н2 = СН4 +Н2О; в) СО + CuO = Сu + CO2; г) 3 CO + Fe2O3 = 3 CO2 + 2Fe.
14. Углерод(IV)-оксид выступает в роли окислителя в реакции с: а) углеродом; б) водой; в) магнием; г) натрий-оксидом.
15. Какие реакции не являются окислительно-восстановительными?
а) Р2О5 + СаО  ; б) СО + О2 ®;
; б) СО + О2 ®;
в) SO3 + H2O ®; г) CO + Fe2O3  .
.
16. Какие реакции являются окислительно-восстановительными? а) СО2 + СаО®; б) СО2 + Mg®; в) СО2 + КОН®; г) СО2 + С®.
17. В каких реакциях алюминий-оксид проявляет свойства основных оксидов? а) Al2O3 + K2O®; б) Al2O3 + HCl®; в) Al2O3 + NaOH + Н2О®; г) Al2O3 + H2SO4 (разб) ®.
18. С какими веществами может реагировать сера(VI)-оксид?
а) P2O5; б) Na2O; в) Н2О; г) О2.
19. Углекислый газ проявляет свойства кислотного оксида, реагируя с: а) углеродом; б) кальций-оксидом; в) магнием; г) натрий-гидроксидом.
20. Какой из перечисленных ниже оксидов обладает амфотерными свойствами? а) барий-оксид; б) цинк-оксид; в) кальций-оксид; г) бериллий-оксид.
21. Укажите схемы реакций, подтверждающие свойства SiO2, как кислотного оксида:
а) SiO2+Mg  ; б) SiO2+CaO
; б) SiO2+CaO  ; в) SiO2+HF®;
; в) SiO2+HF®;
г) SiO2+Са(ОН)2  .
.
22. Какие оксиды при обычных условиях не реагируют с водой? а) углерод(II)-оксид; б) азот(V)-оксид; в) алюминий-оксид;
г) фосфор(III)-оксид.
23. Какие оксиды являются солеобразующими? а) Al2O3; б) N2O3; в) Na2O; г) NO.
24. Какие оксиды являются кислотными? а) железо(II)-оксид;
б) азот(V)-оксид; в) азот(I)-оксид; г) углерод(IV)-оксид.
25. Оксиды каких металлов могут взаимодействовать и с кислотами, и со щелочами? а) натрия; б) цинка; в) алюминия;
г) кальция.
26. Какие вещества реагируют с натрий-гидроксидом?
а) (NH4)2SO4; б) КNO3; в) ZnO; г) SО2.
27. C растворами каких веществ будет реагировать медь(II)-гидроксид? а) HCl; б) KCl; в) H2SO4; г) NaNO3.
28. Какие основания являются слабыми электролитами?
а) Fe(OH)2; б) NH3 · H2О; в) Pb(OH)2; г) KOH.
29. Какие из приведенных ниже оснований являются щелочами? а) натрий-гидроксид; б) алюминий-гидроксид; в) медь(II)-гидроксид; г) барий-гидроксид.
30. Какие основания могут проявлять амфотерные свойства?
а) FrOH; б) Al(OH)3; в) Be(OH)2; г) Са(ОН)2.
31. Какой из гидроксидов обладает наибольшими основными свойствами? а) LiOH; б) NaOH; в) KOH; г) CsOH.
32. Какие из перечисленных ниже реакций осуществимы в водных растворах? а) NaOH + NH4Cl®; б) NaОН + КCl®; в) NaОН + Al(OH)3®; г) NaOH + ZnO + H2O ®.
33. Какое из перечисленных ниже соединений проявляет наиболее сильные основные свойства? а) Cu(OH)2; б) Ca(OH)2;
в) Mg(OH)2; г) NH3 · H2О.
34. С какими веществами реагирует раствор натрий-гидроксида? а) KCl; б) ZnO; в) NH4Cl; г) Al(OH)3.
35. Какие вещества могут реагировать с KОН? а) СО2; б) Zn(OH)2; в) NH4OH; г) О2.
36. Какой из перечисленных ниже гидроксидов металлов обладает амфотерными свойствами? а) KОН; б) Са(ОН)2; в) Zn(OH)2;
г) Cr(OH)3.
37. В молекулах каких кислот центральный атом-неметалл обладает окислительно-восстановительной двойственностью?
а) серной; б) сернистой; в) азотистой; г) угольной.
38. Какая из предложенных кислот является наиболее сильной?
а) HF; б) НCl; в) HBr; г) HI.
39. Какая из перечисленных ниже кислот проявляет самые сильные кислотные свойства? а) Н2СО3; б) Н2SiO3; в) H2SO3;
г) H2SO4.
40. Укажите кислоты, являющиеся сильными электролитами:
а) азотистая; б) азотная; в) фтороводородная; г) иодоводородная.
41. С какими веществами может реагировать разбавленная азотная кислота? а) медь; б) медь(II)-оксид; в) углерод(IV)-оксид;
г) аммоний-сульфид.
42. С какими веществами не будет реагировать разбавленная серная кислота? а) Hg; б) HgO; в) Hg(OH)2; г) Hg(NO3)2.
43. Азотная кислота образуется в результате реакции: а) N2O + H2O®; б) N2O5 + H2O®; в) NH3 + H2O®; г) NO2 + H2O + O2 ®.
44. Какие вещества реагируют с азотной кислотой? а) СО2; б) Р; в) Zn; г) НI.
45. При протекании каких реакций не выделяется водород?
а) Zn + HCl ®; б) Zn + H2SO4 конц.®; в) Zn + H2SO4 разб.®;
г) Zn + НNO3 разб. ®.
46. Кислоты – это электролиты, при диссоциации которых в водных растворах образуются в качестве катионов только: а) катионы аммония; б) гидроксид-ионы; в) атомы водорода; г) ионы гидроксония.
47. С какими веществами не реагирует при обычных условиях концентрированная серная кислота? а) Na; б) Na2CO3; в) Al;
г) СО2.
48. Какие металлы реагируют с концентрированной НNO3 при обычной температуре? а) Са; б) Al; в) Fe; г) Na.
49. С какими металлами реагирует разбавленная серная кислота? а) Cu; б) Al; в) Mg; г) Fe.
50. Серная кислота может быть получена по реакции: а) SO2 + H2O®; б) SO3 + H2O®; в) Na2SO4 + H2CO3®; г) S + HNO3(конц.)®.
51. С какими веществами будет реагировать соляная кислота?
а) медь(II)-гидроксид; б) медь(II)-оксид; в) медь; г) серебро-нитрат.
52. Какие газы при растворении в Н2О не образуют кислоту? а) сероводород; б) аммиак; в) углерод(II)-оксид; г) углерод(IV)-оксид.
53. Какие металлы при н.у. реагируют с разбавленной серной кислотой, но не реагируют с концентрированной серной кислотой? а) медь; б) железо; в) алюминий; г) кальций.
54. В какой группе веществ кислотные свойства увеличиваются слева направо? а) H2S; H2SO4; H2SiO3; б) H2SiO3; H2CO3; H2SO4; в) HF; HCl; HBr; г) HI; HBr; HF.
55. В каких реакциях HNO3 выступает как окислитель? а) Na2O + HNO3 ®; б) Cu + HNO3(конц.) ®; в) Zn + HNO3(разб.) ®;
г) Zn(OH)2 + HNO3(разб.) ®.
56. Самой сильной кислотой из перечисленных ниже является:
а) Н2S; б) H2SO3; в) HBr; г) HF.
57. Какие вещества реагируют с соляной кислотой? а) Al; б) FeO; в) SiO2; г) Cu.
58. Степень электролитической диссоциации Н3РО4 максимальная: а) по первой ступени; б) по второй ступени; в) по третьей ступени; г) одинакова по всем трем ступеням.
59. Какие кислоты не могут образовать кислые соли? а) угольная кислота; б) фосфорная кислота; в) азотистая кислота; г) азотная кислота.
60. С какими соединениями реагирует соляная кислота? а) Cu;
б) CuO; в) Cu(NO3)2; г) Cu(OH)2.
61. Какие вещества не реагируют с НNО3(конц.)? а) P; б) Au; в) CO2; г) Cu.
62. Кремниевая кислота образуется в результате реакции:
а) Si + NaOH + H2O®; б) Na2SiO3 + HCl®; в) SiO2 + H2O®;
г) SiO2 + HF®.
63. Какие кислоты не реагируют с медью? а) фосфорная; б) азотная; в) соляная; г) сероводородная.
64. Соляная кислота не реагирует с: а) железо(III)-оксидом; б) серебром; в) аммоний-сульфатом; г) натрий-сульфидом.
65. При термическом разложении каких нитратов образуется металл? а) Mg(NO3)2; б) Cu(NO3)2; в) Hg(NO3)2; г) AgNO3.
66. Какие газы могут образоваться при разложении нитратов?
а) NH3; б) N2O; в) N2O5; г) NO2.
67. Какие реакции протекают в водных растворах? а) CuCl2 + 2NaOH ®; б) CuCl2 + 2НF ®; в) CuCl2 + Na3PO4; г) CuCl2 + K2SO4 ®.
68. C водными растворами каких веществ будет реагировать аммоний-хлорид? а) HCl; б) КОН; в) AgNO3; г) Mg(NO3)2.
69. С растворами каких солей не будет реагировать свинец?
а) магний-хлорида; б) медь-нитрата; в) серебро-нитрата;
г) железо(II)-сульфата.
70. *В растворах каких солей масса железной пластинки со временем не изменится? а) калий-сульфата; б) алюминий-сульфата; в) никель-сульфата; г) медь-сульфата.
71. В водных растворах каких солей масса железной пластинки будет увеличиваться? а) Cu(NO3)2; б) Mg(NO3)2; в) Pb(NO3)2; г) Ba(NO3)2.
72. Масса магниевой пластинки не будет изменяться при погружении ее в водные растворы: а) калий-хлорида; б) кальций-нитрата; в) медь(II)-нитрата; г) серебро-нитрата.
73. При выдерживании в водном растворе какой соли масса медной пластинки увеличится: а) магний-нитрата; б) свинец(II)-нитрата; в) ртуть(II)-нитрата; г) серебро-нитрата.
74. Масса цинковой пластинки будет уменьшаться при погружении ее в растворы: а) AgNO3; б) FeCl2; в) FeSO4; г) Mg(NO3)2.
75. Соли, в которых степень окисления серы минимальна, называются: а) сульфиды; б) сульфаты; в) сульфиты; г) гидросульфаты.
76. При разложении каких нитратов выделяется кислород?
а) NaNO3; б) NH4NO2; в) Cu(NO3)2; г) Hg(NO3)2.
77. Качественной реакцией на ион РО43- является взаимодействие с ионами: а) натрия; б) аммония; в) серебра; г) калия.
78. С растворами каких солей не будет реагировать Fe? а) NaCl; б) CuCl2; в) MgCl2; г) SnCl2.
79. Какие реакции не являются окислительно-восстановительными?
а) NH4Cl  ; б) KNO3
; б) KNO3  ; в) СаСО3
; в) СаСО3  ; г) NH4 NO3
; г) NH4 NO3  .
.
80. При протекании каких реакций образуется железо? а) FeCl2 + NaOH®; б) FeCl2 + Mg®; в) FeCl2 + Cu®; г) FeO + Mg®.
81. При разложении каких веществ образуются два газа? а) СаСО3; б) H2SiO3; в) Zn(NO3)2; г) AgNO3.
82. Соли аммония разлагаются щелочами с выделением: а) N2;
б) N2O; в) NH3; г) NO2.
83. В водных растворах каких солей масса оловяной пластинки будет увеличиваться? а) AgNO3; б) Ba(NO3)2; в) Cu(NO3)2;
г) Pb(NO3)2.
84. При протекании каких реакций выделяется аммиак?
а) NH4Cl  ; б) NH4NO3
; б) NH4NO3  ;
;
в) NH4NO3+NaOH®; г) NH4Cl+AgNO3®.
85. Какие соли в водных растворах будут реагировать с СuCl2? а) KBr; б) NaNO3; в) AgNO3; г) K2S.
86. Какие реакции в водных растворах являются необратимыми? а) AgNО3 + KBr ®; б) Na2S + CuCl2 ®; в) СaCl2 + NaNO3 ®; г) Ca(OH)2 + NH4Cl ®.
87. Какие реакции в водных растворах являются необратимыми? а) NaOH + NH4NO3®; б) MgSO4 + CuCl2®; в) CuCl2 + KOH®; г) ZnCl2 + HBr®.
88. Какие реакции в водных растворах практически необратимы? а) CaCl2 + KBr®; б) CaCl2 + NaF®; в) Cu(NO3)2 + K2SO4®; г) AgNO3 + K3PO4®.
89. Какие реакции являются реакциями обмена?
а) CuCl2 + 2NaOH ®; б) CuCl2 + Fe ®; в) CuCl2 + F2 ®;
г) CuCl2 + 2AgNO3 ®.
90. При разложении каких солей образуется 2 газообразных вещества? а) KMnО4; б)NH4Cl; в) Mg(NO3)2; г) CaCO3.
91. Какие реакции в водном растворе практически неосуществимы? а) FeCl2 + Zn ®; б) FeCl2 + AgNO3 ®; в) Cu + KCl ®;
г) Fe + MgCl2®.
92. Какие вещества реагируют с фосфатом натрия в водной среде? а) К2SO4; б) CaCl2; в) AgNO3; г) KOH.
93. Соли, в которых степень окисления серы максимальна, называются: а) сульфиды; б) сульфаты; в) сульфиты; г) гидросульфаты.
94. Какие реакции, из перечисленных ниже, не протекают в водном растворе? а) NaBr + HCl ®; б) 2HBr +Na2CO3 ®;
в) HBr + NaOH ®; г) 2 HBr + Na2SO4 ®.
95. C какими веществами будет реагировать СuBr2? а) AgNO3; б) Na3PO4; в) K2S; г) HCl.
96. Для какой схемы химической реакции, протекающей в водной среде, сумма коэффициентов в ее сокращенном ионном уравнении равна 3?
а) Ca(HCO3)2 + Na2CO3®;
б) Са(Н2РО4)2 + 2Са(ОН)2®;
в) Са(NО3)2 + Nа3РО4®;
г) СаСl2 + АlF3®.
97. Для какой схемы химической реакции, протекающей в водной среде, сумма коэффициентов в ее сокращенном ионном уравнении равна 6?
а) Мg(НСО3)2 + NаF®;
б) Аl2(SО4)3 + 8 NаОН®;
в) АlСl3 + АgNО3®;
г) Аl2(SО4)3 + 6 КОН®.
98. Сокращенному ионному уравнению Н+ + ОН- = Н2О соответствуют схемы следующих химических реакций:
а) NаНСО3 + NаОН®;
б) СuОНNО3 + HNO3®;
в) KHSO4 + KOH®;
г) NaHCO3 + BaOHNO3®.
99. Сокращенному ионному уравнению Са2+ + СО32-= СаСО3 соответствуют схемы следующих химических реакций:
а) СаО + Н2СО3®;
б) СаСl2 + Na2CO3®;
в) Ca(OH)2 + H2CO3®;
г) Ca + H2CO3®.
100. В каком ряду все оксиды, реагируя с водным раствором КОН, могут образовывать кислые соли?
а) СО2, СlО2, SО2, NО2;
б) N2O3, P4O6, Cr2O3, Fe2O3;
в) SO3, CrO3, P4O6, N2O5;
г) SО2, CO2, P4O10, SO3.
101. В каком ряду все оксиды, реагируя с водным раствором NaOH, могут образовывать только средние соли?
а) ZnO, BeO, SO2, Mn2O7;
б) N2O3, N2O5, Cl2O7, P2O5;
в) NO2, Cl2O, Cl2O7, N2O3;
г) Al2O3, P2O3, CrO3, B2O3.
102. В каком ряду все оксиды при комнатной температуре могут реагировать с водными растворами щелочей?
а) SiO2, CO2, NO2, SO2;
б) FeO, ZnO, CO, NO;
в) Al2O3, N2O3, P2O5, ZnO;
г) SO3, CrO3, Cl2O, Br2O.
103. Только кислая соль образуется в результате взаимодействия:
а) 2 моль СО2 с раствором, содержащим 1 моль Са(ОН)2;
б) 2 моль Р2О5 с раствором, содержащим 2 моль Са(ОН)2;
в) 2 моль SО2 с раствором, содержащим 2 моль NaOH;
г) 2 моль N2O5 с раствором, содержащим 2 моль КОН.
104. Только средняя соль образуется при взаимодействии:
а) 2 моль СО2 с раствором, содержащим 2 моль Са(ОН)2;
б) 1 моль P2O5 с раствором, содержащим 2 моль Ва(ОН)2;
в) 2 моль NO2 с раствором, содержащим 1, 5 моль NaOH;
г) 3 моль SO3 с раствором, содержащим 5 моль NaOH.
105. Смесь средней и кислой солей образуется при взаимодействии:
а) 1 моль P2O5 с раствором, содержащим 2, 5 моль Са(ОН)2;
б) 2, 5 моль СО2 с раствором, содержащим 5 моль NaOH;
в) 3 моль N2O5 с раствором, содержащим 2, 5 моль КОН;
г) 5 моль SO2 с раствором, содержащим 11 моль NaOH.
106. В каком ряду расположены только кислотные оксиды?
а) N2O3, NO2, N2O5, Cl2O7;
б) CrO3, MnO2, P2O3, Cr2O3;
в) Cl2O, N2O, CO, SO;
г) P4O10, NO2, P4O6, Mn2O7.
107. В каком ряду расположены только амфотерные оксиды?
а) Al2O3, P2O3, Cr2O3, N2O3;
б) BeO, ZnO, MnO2, Fe2O3;
в) B2O3, Fe3O4, N2O, P2O3;
г) NO, CuO, CO, SiO.
108. В каком ряду все оксиды при комнатной температуре являются твердыми веществами?
а) NO2, CO2, PbO2, SO2;
б) SiO2, MnO2, SnO2, GeO2;
в) N2O, CuO, Na2O, Cl2O;
г) SO3, Cl2O3, N2O3, NO.
109. В каком ряду все кислоты могут реагировать с Сu?
а) H2S, H3PO4, HI;
б) H2SO4(разб.), HNO3(разб.), H2SO3;
в) H2SO4(конц.), HNO3(конц.), HNO3(разб.);
г) HNO3(разб.), HBr, H3PO4.
110. В каком ряду все кислоты при хранении (особенно на свету) могут самопроизвольно разлагаться?
а) H2SO4, H3PO4, НF;
б) HNO3, H2СO3, H2SiO3;
в) НСl, HPO3, HNO2;
г) H2SO4, H2CrO4, H2SO3.
111. В каком ряду расположены только сильные кислоты?
а) HCl, HBr, HI, HF;
б) HNO2, HF, H2SO3, H3PO4;
в) HCl, HBr, H2SO4, HNO3;
г) H2SiO3, H2S, H3PO3, HClO4.
112. В каком ряду кислотные свойства соединений закономерно возрастают слева направо?
а) HClO, HClO2, HClO3, HClO4;
б) H2SO4, HClO4, HBrO4, HIO4;
в) HF, HCl, HBr, HI;
г) H2SeO4, H2SO4, H3AsO4, H3PO4.
113. Кислоты какого ряда при взаимодействии с железом выделяют водород?
а) HI, H2SO4(разб.), HNO3(разб.);
б) H2SO4(конц.), HNO3(конц.), HNO3(разб.);
в) HI, HCl, HBr;
г) H2SO4(разб.), HСООН, HBr.
114. В каком ряду все кислоты при комнатной температуре могут растворять железо?
а) H2SO4(разб.), HCl, HСООН;
б) HNO3(разб.), HBr, H2SO4(конц.);
в) HNO3(конц.), HNO3(разб.), H2SO4(конц.);
г) HI, HNO3(разб.), H2SO4(разб.).
115. Кислоты какого ряда, реагируя с Аl, не выделяют водород?
а) HNO3(разб.), HBr, H2SO4(разб.);
б) HCl, H2SO4(разб.), H2SO4(конц.);
в) H2SO4(конц.), HNO3(конц.), HNO3(разб.);
г) HCl, HF, HBr.
116. Кислоты какого ряда при обычных условиях могут существовать только в виде разбавленных водных растворов?
а) H2SO4, H2S, H2SiO3;
б) Н2СО3, HNO2, H2SO3;
в) H3PO4, HF, HNO3;
г) HI, HBr, H2SO4.
117. Даны вещества, формулы которых: CuO, Na2S, Fe, AlCl3, NaHSO4, (CaOH)2SO4. Какое число из них может реагировать с H2SO4(разб.)? а) 2; б) 3; в) 4; г) 5.
118. Все металлы какого ряда на воздухе при комнатной температуре растворяет H2SO4(конц.)?
а) Mn, Mg, Ag, Au;
б) Zn, Fe, K, Pt;
в) Li, Cu, Cr, Al;
г) Na, Mg, K, Cs.
119. Все металлы какого ряда на воздухе при комнатной температуре не растворяет H2SO4(конц.)?
а) Ag, Na, Hg, Au;
б) Fe, Pt, Al, Au;
в) Cr, Pb, Mg, Sn;
г) Mn, Ni, Mo, Fr.
120. Со всеми металлами какого ряда при комнатной температуре может реагировать H2SO4(разб.)?
а) Al, Fe, Mg, Zn;
б) Cu, Ag, Ni, Cd;
в) Cr, Ni, Al, Mg;
г) Ca, Au, Co, Hg.
121. Со всеми металлами какого ряда реагирует HNO3(разб.)?
а) Ag, Hg, Cu, Zn;
б) Fe, Al, Mg, Ni;
в) Pb, Sn, Au, Co;
г) Zn, Mg, Al, Hg.
122. В каком ряду все приведенные основания являются щелочами?
а) Cu(OH)2, Al(OH)3, Fe(OH)2;
б) KOH, Ca(OH)2, Zn(OH)2;
в) NaOH, Ba(OH)2, LiOH;
г) NH3 ∙ H2О, Mg(OH)2, Be(OH)2.
123. В каком ряду все основания при нагревании разлагаются на оксид металла и воду, не образуя расплава?
а) LiOH, Mg(OH)2, NaOH;
б) Bе(OH)2, Zn(OH)2, Mg(OH)2;
в) NaOH, KOH, LiOH;
г) Al(OH)3, Fe(OH)2, Fe(OH)3.
124. В каком ряду все приведенные основания при взаимодействии с кислотами могут образовать основные соли:
а) LiOH, NaOH, KOH;
б) Ca(OH)2, Ba(OH)2, Mg(OH)2;
в) Al(OH)3, Fe(OH)3, Cr(OH)3;
г) Zn(OH)2, Be(OH)2, LiOH.
125. В каком ряду все приведенные основания являются сильными электролитами?
а) Ca(OH)2, Be(OH)2, Mg(OH)2;
б) Cu(OH)2, Ba(OH)2, Zn(OH)2;
в) LiOH, KOH, NaOH;
г) Al(OH)3, Fe(OH)3, Cr(OH)3.
126. Со всеми веществами какого ряда при комнатной температуре может реагировать водный раствор NaOH?
а) Al(OH)3, H2SO4, CO2, N2;
б) Ba(OH)2, Zn(OH)2, Cu(OH)2, MgO;
в) SO3, Al2O3, Al, HCl;
г) SiO2, N2O, Cl2O, CO.
127. Со всеми веществами какого ряда при соответствующих условиях может реагировать Аl(ОН)3?
а) HCl, NaOH, P2O5;
б) Na2O, NH3, ZnO;
в) K2O, H2SO4, HI;
г) CO2, N2, Cu(OH)2.
128. Электролиз водных растворов солей какого ряда может быть использован для получения оснований?
а) LiCl, CaCl2, CuCl2;
б) NaCl, BaCl2, KCl;
в) HgCl2, MgCl2, BeCl2;
г) AlCl3, AuCl3, CuCl2.
129. Укажите схему химической реакции, протекающей в водной среде, которая может быть использована для получения основания:
а) K2SO4 + NaOH®;
б) Na[Al(OH)4] + 1HCl®;
в) Cu(NO3)2 + Ba(OH)2®;
г) KNO3 + Cu(OH)2®.
130. Схема какой химической реакции, протекающей в водной среде, может быть использована для получения щелочи?
а) Na2SO4 + Ba(OH)2®;
б) BaCl2 + KOH®;
в) NaCl + H2O 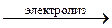
г) FeCl3 + NaOH®.
131. С водными растворами солей какого ряда может реагировать раствор Ва(ОН)2?
а) NaCl, Cu(NO3)2, Al2(SO4)3;
б) K2SO4, Na3PO4, Fe(NO3)3;
в) KNO3, NaBr, Pb(NO3)2;
г) CaBr2, CH3COONa, ZnCl2.
132. Укажите схему химической реакции, которая может протекать в водной среде:
а) Na2SO4 + H2S®;
б) Na2CO3 + HCl®;
в) Ba(NO3)2 + Ca(OH)2®;
г) Ca(HCO3)2 + NaCl®.
133. Укажите схему химической реакции, которая не протекает в водной среде, но может быть осуществлена в отсутствии Н2О:
а) NaNO3 + H2SO4®;
б) NaCl + HNO3®;
в) HCl + Na2SO4®;
г) Na2SO4 + H3PO4®.
134. Укажите схему химической реакции, которая может протекать как в водной среде, так и при отсутствии Н2О:
а) Al(OH)3 + NaOH®;
б) KOH + NaCl®;
в) P2O5 + NaOH®;
г) ZnO + KOH®.
135. При помещении в водные растворы солей какого ряда масса железной пластинки будет увеличиваться?
а) ZnCl2, CuSO4, AlCl3;
б) Pb(NO3)2, AgNO3, NiSO4;
в) BaCl2, MgCl2, KCl;
г) Cr(NO3)3, MnSO4, Na3PO4.
136. В каком ряду все соли при нагревании плавятся, не разлагаясь?
а) NaCl, Na2CO3, Na2SO4;
б) NH4Cl, AgBr, K2S;
в) CaCO3, Zn(NO3)2, KMnO4;
г) CuCl2, Hg(NO3)2, (NH4)2Cr2O7.
137. При разложении солей какого ряда образуются 2 газа?
а) NH4Cl, (NH4)2S, Cu(NO3)2;
б) Ca(NO3)2, CaSO3, CaSO4;
в) KMnO4, KClO3, KNO3;
г) BaCO3, (NH4)2Cr2O7, Ba(HCO3)2.
138. Укажите схему окислительно-восстановительной реакции:
а) NH4Cl  ;
; 
б) (NH4)2CO3  ;
;
в) NH4NO3  ;
;
г) NH4NO2  .
.
139. Укажите схему окислительно-восстановительной реакции:
а) Са(НСО3)2(раствор)  ;
;
б) Mg(NO3)2  ;
;
в) KMnO4  ;
;
г) MgCO3  .
.
140. Укажите схему химической реакции, которая может быть использована для получения соляной кислоты:
а) NaCl(р-р) + HF(р-р)®;
б) BaCl2(р-р) + H2SO4(р-р)®;
в) AgCl(тв.) + HNO3(р-р)®;
г) H2SO4(конц.) + Cl2®.
141. Укажите схему химической реакции, протекающей в водной среде, которая может быть использована для получения кальций – фосфата:
а) 3Ca + 2H3PO4®;
б) 1Ca(H2PO4)2 + 1Ca(OH)2®;
в) 2H3PO4 + 3Ca(OH)2®;
г) 3CaCl2 + 2Na3PO4®.
142. Укажите схему химической реакции, протекающей в водной среде, которая может быть использована для получения меди:
а) Na + CuCl2®;
б) Au + CuSO4®;
в) Ag + Cu(NO3)2®;
г) Fe + CuBr2®.
143. Основная соль образуется при взаимодействии между собой:
а) 2 моль Аl(ОН)3 и 4 моль НСl;
б) 2 моль Fe(OH)3 и 4 моль H2SO4;
в) 4 моль NaOH и 1 моль H2SO4;
г) 1 моль Fe(OH)2 и 1 моль НСl.
144. Смесь двух солей: средней и кислой, образуется при взаимодействии между собой:
а) 2 моль Н3РО4 и 2, 5 моль Са(ОН)2;
б) 1, 5 моль Н3РО4 и 2, 25 моль Са(ОН)2;
в) 3 моль Н3РО4 и 2 моль Са(ОН)2;
г) 2 моль Н3РО4 и 3 моль Са(ОН)2.
145. Укажите схему химической реакции, при протекании которой исходная соль превращается в среднюю:
а) Ca(H2PO4)2 + 2Ca(OH)2®;
б) NaHCO3 + NaOH®;
в) Na2HPO4 + 1HCl®;
г) BaOHNO3 + HNO3®.
146. Даны вещества, формулы которых: K2SO4, HCl, H2SO4(конц.), KOH, CuCl2, С2Н5ОН. Какое число из них при соответствующих условиях может реагировать с Nа3РО4? а) 3; б) 4; в) 5; г) 6.
147. Даны вещества, формулы которых: NaCl, Na2CO3, NaOH, NaHCO3, Na3PO4, NaNO3. Какое число из них в водном растворе может реагировать с Са(НСО3)2? а) 2; б) 3; в) 4; г) 5.
148. Даны вещества, формулы которых: Ni(NO3)2, K2SO4, CO2, AlCl3, Ba(OH)2, NH3. Какое число из них в водном растворе может реагировать с NaOH? а) 2; б) 3; в) 4; г) 5.
149. Какая масса осадка образуется при сливании растворов, содержащих 10 г NaOH и 13, 6 г ZnCl2? а) 7, 425 г; б) 8, 10 г;
в) 16, 2 г; г) 20, 25 г.
150. В растворе объемом 500 см3 содержится соляная кислота массой 1, 825 г. Укажите рН данного раствора: а) 1, 0; б) 2, 0;
в) 3, 0; г) 4, 0.
151. Вещество, формула которого AlCl3, в качестве одного из основных продуктов образуется при взаимодействии:
а) 1 моль Na3[Al(OH)6] и 3 моль НСl;
б) 1 моль NaAlO2 и 4 моль НСl;
в) Аl4С3 и НСl;
г) Al2(SO4)3 и BaCl2.
152. Серная кислота не может образоваться в качестве одного из основных продуктов при взаимодействии между собой:
а) SO2 и HI;
б) CuSO4 и H2S;
в) S и HNO3;
г) SO3 и H3PO4.
153. Азотная кислота не может образоваться в качестве одного из основных продуктов при взаимодействии между собой:
а) KNO3(тв.) и Н2SO4(конц.);
б) N2O и Н2SO4(разб.);
в) N2 и Н2SO4(конц.);
г) NO2 и NН3.
154. Укажите схему реакции, при протекании которой все образующиеся вещества являются кислотными и амфотерными оксидами:
а) S + H2SO4 (конц.) ®;
б) Al (NO3)3  ;
;
в) С6Н6 + О2 ®;
г) CuS + О2 ®.
155. Алюминий гидроксид не может образоваться в качестве одного из основных продуктов при взаимодействии между собой:
а) AlCl3 и NаОН(изб.);
б) AlCl3 и NН3 ∙ Н2О(изб.);
в) AlCl3 и Cu(ОН)2(изб.);
г) Аl4С3 и Н2О(изб.).
156. Атомы трех элементов меняют степень окисления при термическом разложении следующего вещества: а) Hg(NO3)2;
б) (NH4)2Cr2O7; в) CaSO3; г) CaCO3.
157. Со всеми веществами какого ряда реагирует разбавленная серная кислота?
а) Mg, S, NH3, Ag2O;
б) С, CO, CO2, CuO;
в) HgO, K2S, Fe, (NH4)2CO3;
г) AlCl3, P4, KOH, MgO.
158. Желтым осадком, образовавшимся в ходе качественной реакции, может быть: а) CuS; б) CaCO3; в) Ca3(PO4)2; г) Ag3PO4.
159. Слили два раствора. Один раствор получили при растворении в 400 см3 воды 40 г SO3. Второй раствор образовался в результате растворения в 500 см3 воды 23, 5 г К2О. Среда в полученном растворе будет: а) кислой; б) щелочной; в) нейтральной; г) сначала кислой, а затем щелочной.
160. В 500 см3 10%-ного раствора HCl (ρ = 1, 1 г/см3) растворили 150 дм3 NH3 (объем измерили при t = 25оС и р = 125 кПа). Среда в получившемся растворе будет: а) кислая; б) щелочная; в) нейтральная; г) сначала щелочная, а затем кислая.