
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Потенциальные проблемы, связанные с загрузкой зондов
|
|
Компартментализация – накопление красителя в органоидах и, как следствие, неравномерное распространение внутри клетки. Особенно важно минимизировать компартментализацию для измерения [Ca2+] в цитозоле, так как концентрация и направленность изменений концентрации кальция в органеллах отличны от таковых в цитозоле. Степень компартментализации зависит как от типа индикатора и условий загрузки, так и от типа клеток. Основная причина компартментализации – это неполный гидролиз красителя в цитозоле, что позволяет липофильным АМ эфирам проникнуть во внутриклеточные компартменты, в которых также содержатся эстеразы. Это явление используется для избирательной нагрузки кальциевыми зондами митохондрий при пониженной (для подавления активности эстераз) температуре. Степень компартментализации легко определить при использовании систем анализа изображений, в отличие от систем регистрации флуоресценции с помощью фотоэлектронных умножителей.
Неполный гидролиз АМ эфира. Остаточные негидролизованные АМ эфиры могут присутствовать во внеклеточной среде (недостаточная отмывка). Также у некоторых типов клеток достаточно низкие уровни внутриклеточной эстеразной активности, что и приводит лишь к частичному гидролизу АМ эфира и образованию Са2+-нечувствительных соединений. Регистрация флуоресценции таких соединений может искажать полезный сигнал, отражающий собственно уровень кальция. Для количественного определения этих эффектов, можно применять тушение ионами Mn2+ и другими парамагнитными катионами, которые связываются лишь с полностью деэстерефицированными молекулами индикатора.
Утечка красителя. В некоторых типах клеток краситель вытекает из цитозоля во внеклеточную среду. Это явление отчасти объясняется действием анионной транспортной системы, которую можно ингибировать пробенецидом и сульфинпиразоном или пониженной температурой. Также на утечку красителя может влиять заряд индикатора (для понижения уровня утечки предпочтительнее положительный заряд). А длительное воздействие на клетки Pluronic F-127, наоборот, способствует утечке красителя. Ратиометрические измерения помогают минимизировать влияние утечки индикатора в экспериментальных данных. Существуют также красители (Fura-PE3, Indo-PE3, Fluo-LR), которые хорошо «удерживаются» (retention) в клетке. Напротив, мембранно-непроницаемые декстраны приходится постоянно вводить в клетку во время эксперимента микропипеткой.
| 
|
| А | Б |
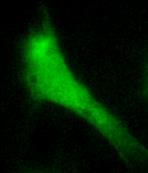
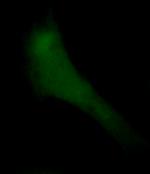
| Рис. 47. Культура фибробластов, окрашенная Fluo-4. А – в начале эксперимента; Б – через 45 сек. Видно уменьшение уровня флуоресценции, вследствие фотодеструкции красителя. |
Выгорание. Освещение флуоресцентных индикаторов интенсивным коротковолновым светом неизбежно приводит к фотодеструкции красителя (photobleaching – фотообесцвечивание или фотовыгорание), поэтому нужно применять как можно меньшую плотность возбуждающего света, но удовлетворительную по параметру сигнал/шум (рис.47).
Наиболее чувствительны к выгоранию нератиометрические красители. Для уменьшения степени фотообесцвечивания добавляют антиоксидант (например, аскорбиновую кислоту) в клеточный буфер. Кроме того, при фотодеструкции красителя высвобождается достаточное для дестабилизации клеточного гомеостаза количество активных форм кислорода (АФК). Наибольшее негативное влияние АФК наблюдается при локализации красителя в митохондриях. Результатом таких эффектов часто является увеличение уровня цитозольного кальция, образование проницаемых пор в митохондриях. Поэтому при измерении динамики кальция в клетках флуоресцентными методами необходимо ставить контрольные эксперименты.
Внутриклеточный буфер кальция. Обычно ионные индикаторы выступают в роли хелаторов для специфических ионов: именно связывание иона с индикатором вызывает изменение спектральных характеристик и интенсивности флуоресценции. Присутствие Са2+-зонда как дополнительного Са2+ буфера может искажать кальциевые сигналы в клетках. Особенно это заметно при одновременной загрузке несколькими кальциевыми индикаторами. Поэтому индикаторы с низким сродством к Са2+ предпочтительнее при равных концентрациях, чем высокоаффинные.
|
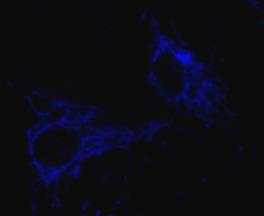
| Рис.48.Культура клеток эндотелия аорты крысы – аутофлуоресценция NADH локализована в митохондриях. |
Аутофлуоресценция. Существует большое количество клеточных компонентов, которые могут флуоресцировать независимо от присутствия индикаторов, например, волокна коллагена, хлорофилл. Однако, самая серьезная проблема при измерении [Ca2+]i с помощью зондов, возбуждаемых УФ, связана с аутофлуоресценцией пиридиновых нуклеотидов (NADH, NADPH), флавиновых нуклеотидов (FAD, FMN). NADH флуоресцирует в восстановленной форме (рис.48). Максимум его возбуждения ~340нм и эмиссии 440-470нм. FAD флуоресцирует в окисленной форме с максимум возбуждения ~450нм, эмиссии 520-540нм. Необходимо точно определять вклад аутофлуоресценции в контрольных экспериментах.
Цитотоксичность. Некоторые индикаторы могут быть токсичными для определённых типов клеток, потому нужно правильно выбирать тип красителей и концентрацию, учитывая чувствительность клеток.
Связывание с другими ионами или белками. Индикаторы, связываясь с внутриклеточными белками, могут изменять свои флуоресцентные свойства, такие как Kd, спектр эмиссии. Также на характерные свойства индикаторов может влиять связывание с другими внутриклеточными ионами, например, при уменьшении рН константа диссоциации комплекса красителя с Са2+ увеличивается. Также следует иметь в виду связывание индикаторов с ионами Mg2+ и других двухвалентных катионов: (Mn2+, Co2+, Zn2+, Ba2+, Cd2+).