
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Обработка полученных результатов
|
|
Использование систем анализа изображений при исследовании динамики кальция в клетках позволяет получать временные серии микрофотографий клеток. Каждая серия состоит из последовательно полученных изображений клеток, нагруженных кальциевым индикатором, с одного и того участка исследуемого образца, причем каждому кадру соответствует известное время от начала эксперимента. Анализируя интенсивность флуоресценции красителя в определенной области интереса (ROI) на каждом кадре можно построить зависимость средней флуоресценции в каждой области интереса от времени. Результатом является график, на котором отражается изменение концентрации кальция в клетках. В случае цифровых изображений такая зависимость строиться на основе анализа яркости пикселей (как правило, для измерения кальция достаточно 8-битных изображений, т.е. 256 градаций яркости), заключенных в область интереса.
|
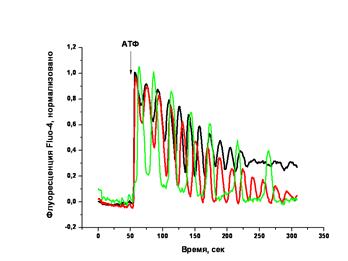
| Рис.49.Динамика уровня цитозольного кальция, измеренного по флуоресценции Fluo-4 в клетках карциномы HEp-2. После добавления стимулирующего вещества (АТФ) наблюдаются осцилляции цитозольного кальция в клетках. Представлены графики для трех отдельных клеток из одного эксперимента. Отнормировано на максимальный сигнал. |
На практике серия изображений сначала преобразуется сглаживающим усредняющим фильтром со значением 3х3. После этого на изображении в ручном (с помощью полилинии) или автоматическом (с помощью инструмента «волшебная палочка», или другими специальными методами) режиме выделяются области интереса – ROIs (в зависимости от конкретной задачи этими областями могут обрисовываться изображения отдельных клеток, ядерных областей, скопления митохондрий и т.д.). Каждому из таких выделений присваивается имя. Далее программными алгоритмами происходит вычисление среднего (реже суммарного) значения яркости пикселей в каждой области интереса для каждого кадра серии. Результатом является таблица, где в одной колонке представлены номер кадра или значение времени соответствующего кадра, а в другой – среднее арифметическое яркости пикселей, заключенных в область выделения. Помимо таблицы, многие программы позволяют представить результат анализа серии изображений в виде графика (рис.49).
Очевидно, при ратиометрических измерениях процесс обработки несколько усложняется. В эксперименте получают изображения в двух различных каналах, т.е. имеется две временные серии изображений. При этом вычисления концентрации кальция можно выполнять путем математических манипуляций с собственно сериями изображений (по сути, со значениями интенсивности пикселей), либо с полученными графиками зависимости интенсивности флуоресценции от времени. Отдельно выполняются калибровочные эксперименты.
Имеется набор программных продуктов, позволяющих анализировать временные серии изображений. Большинство из них имеют специальные функции для пересчета интенсивностей флуоресценции в концентрации кальция в автоматическом режиме. Бесплатная и удобная программа – ImageJ с плагином Time series analyzer (https://rsb.info.nih.gov/ij/), пакет Lucida компании Kinetic Imaging, специальные модули для программного обеспечения микроскопов фирм-производителей (Leica, Carl Zeiss).
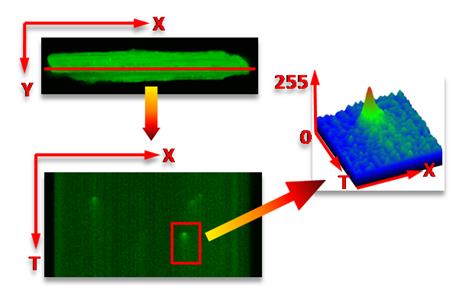
Оригинальным программным продуктом является плагин для ImageJ – SparkMaster, позволяющий анализировать конфокальные изображения, полученные в режиме сканирования XT. При этом программа в автоматическом режиме находит кальциевые спарки (спонтанные выбросы кальция из одиночных кластеров каналов саркоплазматического ретикулума) и подсчитывает такие параметры, как амплитуда и продолжительность, время достижения максимума и ряд других (рис.50).
|
| Рис.50.Кальциевые спарки. Вверху – одиночное конфокальное изображение кардиомиоцита, нагруженного зондом Fluo-4. Красная линия вдоль клетки – линия сканирования в режиме XT. Внизу – результат XT-сканирования. По горизонтали – длина клетки, по вертикали – время. Сканирование – 500 линий в секунду. Справа – профиль одиночного кальциевого спарка (по вертикали – интенсивность пикселей в формате 8 бит). Из рисунка видно, что, зная время сканирования каждой линий и пространственную координату вдоль клетки можно количественно определить параметры кальциевых спарков, частоту возникновения спарков в одном и том же месте. |
Заключение
Измерение концентрации ионов кальция в цитоплазме живых клеток с помощью видео-микроскопии и чувствительных к кальцию флуоресцентных зондов в настоящее время является широко распространенным методом. Необходимость измерения концентрации ионов Са2+ обусловлены его участием, как основного вторичного мессенджера в регуляции активности многих белков в клетке и электрических потенциалов на цитоплазматической мембране.
Использование конфокальных микроскопов и приборов анализа изображения одиночной клетки открывает совершенно новые подходы к познанию молекулярных механизмов управления функциями клеток в частности связанных с возможностью анализа не только статистических но и локальных единичных событий в клетке.